|
| Ubicación y plano de Page-Ladson, Florida. C muestra la localización de huesos y artefactos. |
Algunos de los yacimientos más antiguos del Nuevo Continente se encuentran en América Latina, pero están sujetos a polémica (
Monte Verde, Chile, antes de 25 ka,
Dillehay et al, 2015;
Tlapacoya, México, 24 ka;
Toca da Tira Peia, Piauí, Brasil 22 ka;
Arroyo del Vizcaíno, Uruguay 30-27 ka;
Taima Taima, Coro Venezuela 14,44 ka;
Pikimanchay, Ayacucho, Perú, 20 ka;
Pedra Furada, Serra da Capivara, este de Piauí, Brasil, 32,16 ka y
20 ka;
Toca do Serrote das Moendas, São Raimundo Nonato, Piauí, Brasil, 29-24 ka;
Abrigo de Toca do Sitio do Meio, Serra da Capivara, este de Piauí, Brasil, 14,3 ka).
En Alaska y Canadá existen lugares con restos fechados hasta en 27 ka (
Bluefish II, 24,82 ka; Swan Point, Little John, Broken Mammoth y Mead; Easton et al, 2013; Goebel et al, 2008; Hoffecker y Elias, 2003), pero los datos fiables no van más allá de los 15,5-13,9 ka.
Rimrock Draw Rockshelter, en Riley, Oregón, con más de 15,8 ka,
Debra L. Friedkin, Texas, 15,5-13,2, la cueva de Wilson Butte, en Idaho, con 14,5-13 ka,
Schaefer y Hebior, Wisconsin 14,5 ka, la cueva de Fort Rock, en Oregón, de 13,25 ka y otros yacimientos de Pennsylvania y Florida con unas edades de 12 ka. En 2011 se dató en 13,8 ka una punta de lanza hallada en el fósil de una costilla de mastodonte de Manis (Washington) y en 13,2 un conjunto de más de 15.000 artefactos de piedra hallados en el centro de Texas. En 2014 se dató en 22 ka un cráneo de mastodonte hallado en 1974 en la
Bahía de Chesapeake junto a dos herramientas líticas, pero no está claro que estén asociados (
Dennis Stanford et al, 2014). En 2015,
Michael R. Waters et al dataron los restos de Wally's Beach, Canadá, de siete caballos y un camello luego de ser descuartizados, así como 29 núcleos y lascas no diagnosticables, obteniendo una fecha media de 13,3 cal ka. Los animales fueron sacrificados en un periodo corto. En las Cavernas Paisley (Oregón) aparecieron coprolitos datados en 14,3 ka y que se pensó procedían de humanos, pero según el análisis de
A. Sistiaga et al (2013), corresponden a herbívoros. Asociadas a coprolitos más recientes (13,2 ka), aparecieron puntas de lanza Western Tallo.
 |
| Page-Ladson. Estratigrafía y dataciones. |
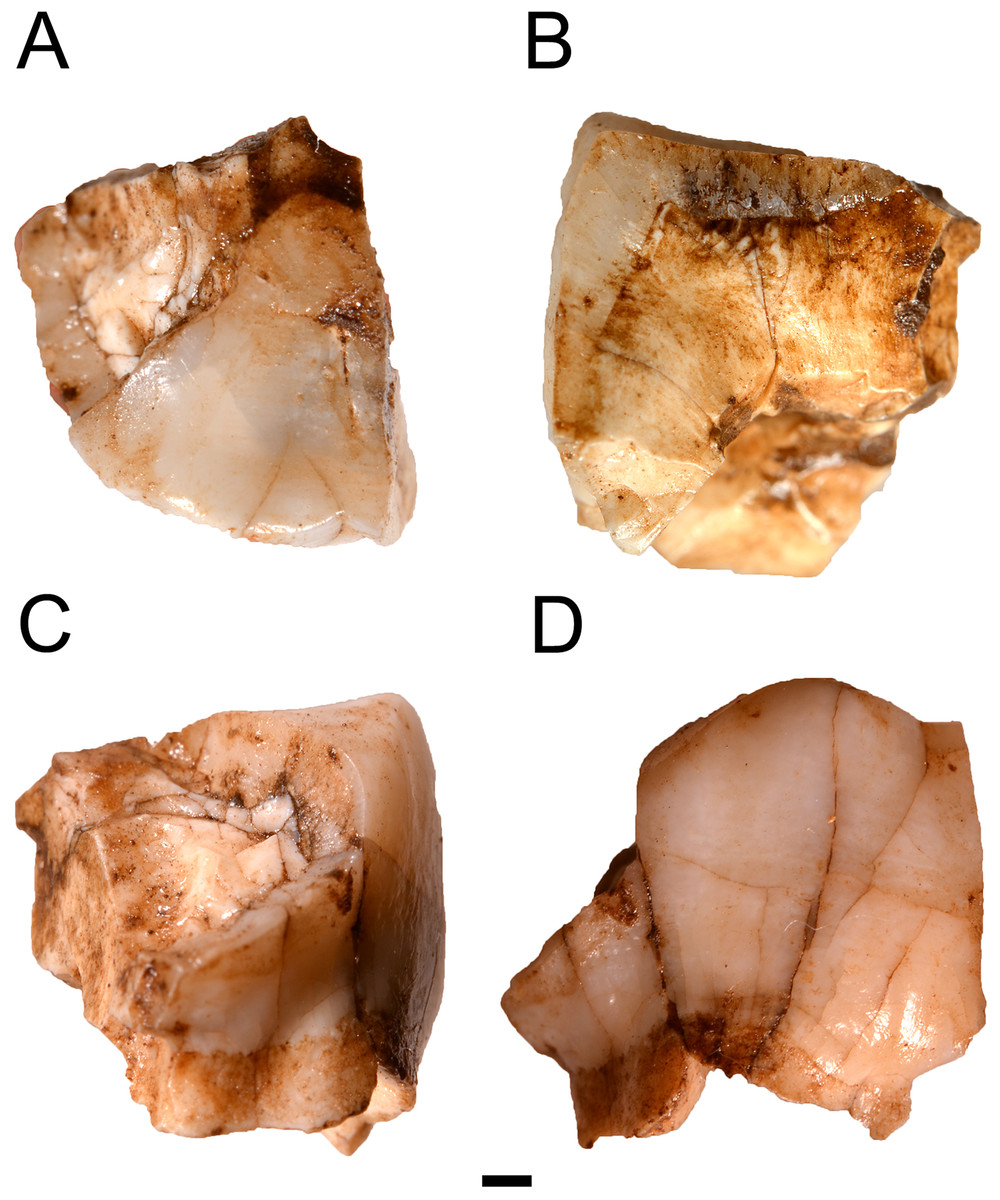
Jessi J. Halligan, Michael R. Waters, Angelina Perrotti, Ivy J. Owens, Joshua M. Feinberg, Mark D. Bourne, Brendan Fenerty, Barbara Winsborough, David Carlson, Daniel C. Fisher, Thomas W. Stafford Jr y James S. Dunbar han datado los hallazgos de herramientas de piedra junto con un mastodonte cazado o carroñeado, en un contexto geológico no perturbado y de estratigrafía clara, en un pozo del río Aucilla, en Page-Ladson, Florida.
- 71 dataciones por radiocarbono han proporcionado una fecha de hace ca 14.550 años cal BP.
La superficie de ocupación fue enterrada por ca 4 m de sedimentos durante la transgresión marina del Pleistoceno Tardía, que también dejó el sitio sumergido. Actualmente el yacimiento está 9 m bajo el agua, limitado por roca madre en todo su perímetro. Fue objeto de excavación en 1983-1997, cuando se hallaron ocho artefactos de piedra asociados con un mastodonte descuartizado. El yacimiento permaneció en un estatus ambiguo hasta que en 2012-2014 se retomaron las investigaciones para datar los hallazgos de forma segura, recuperándose seis herramientas líticas adicionales.
Sporormiella, un hongo que solo aparece en el estiércol de los herbívoros, ha sido utilizado como proxy para establecer el momento de la extinción la megafauna en América del Norte. En Page-Ladson, el pico de esporas ocurre hace ca 13.700 años cal BP y decae rápidamente, desapareciendo hace ca 12.600 años cal BP, durante el estadial Younger Dryas.
El poblamiento de América